Kochen und Essen hat nicht nur mit Genuss zu tun. Grundlegende physikalische und chemische Prozesse bestimmen Geschmack, Aroma und Konsistenz der zubereiteten Speisen.
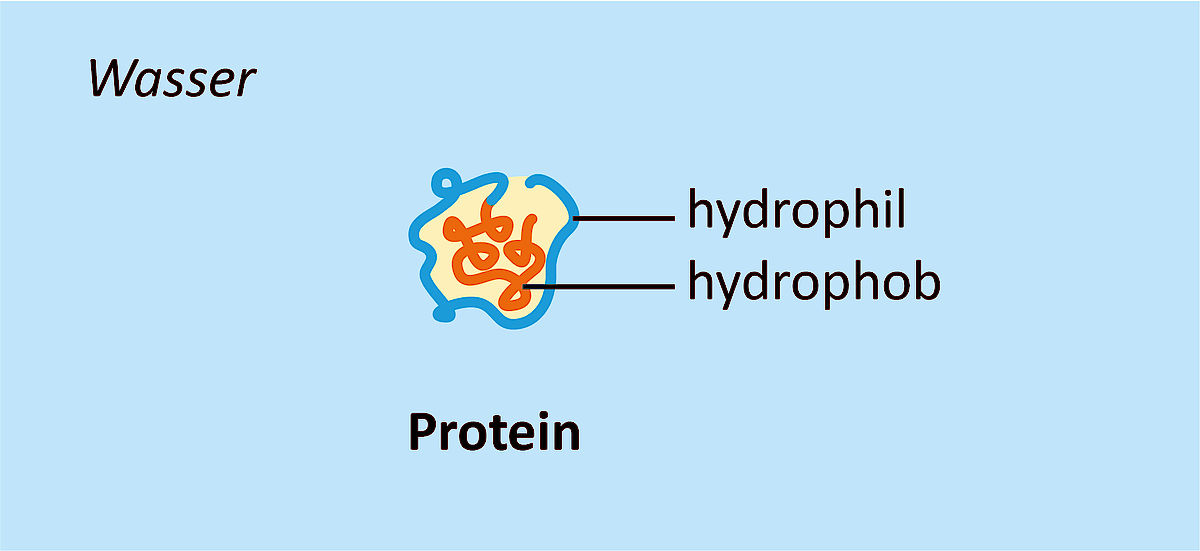
Löslichkeit in Wasser und Proteinaggregation
Polare Stoffe wechselwirken stark mit Wasser. Man bezeichnet sie als hydrophil (wasserliebend). Andere, unpolare Stoffe wechselwirken nicht mit Wasser und werden als hydrophob (wassermeidend) bezeichnet. Innerhalb eines Proteins findet man hydrophile und hydrophobe Abschnitte. Sie bewirken die Faltung des Proteins im dreidimensionalem Raum. Hydrophile Abschnitte sind nach aussen gerichtet, da das Zellmilieu wässrig ist, während die hydrophoben Abschnitte im Innern verpackt sind. Bei einer Denaturierung können hydrophobe Abschnitte durch eine Neufaltung an die Oberfläche gelangen. Dadurch sind die Proteine nicht mehr im Wasser löslich. Die hydrophoben Abschnitte verschiedener Proteine interagieren miteinander und bilden Klumpen. Das bezeichnet man als Aggregation.
Denaturierung
Proteine bestehen aus langen Aminosäureketten, die sich zu komplexen dreidimensionalen Gebilden zusammenfalten. Ab Temperaturen von etwa 42 °C beginnen Proteine zu denaturieren, d. h. ihre dreidimensionale Struktur zu verlieren. Die Aminosäurekette entfaltet sich oder faltet sich zu einer neuen Struktur zusammen. Das führt bei den Körperproteinen zu einem Funktionsverlust – deshalb ist hohes Fieber gefährlich. Beim Kochen bewirkt eine Proteindenaturierung ein Gerinnen der Proteine (z. B. Ei). Proteine können aber auch durch Zugabe von Säure oder durch mechanische Beanspruchung (Eischnee) denaturieren.
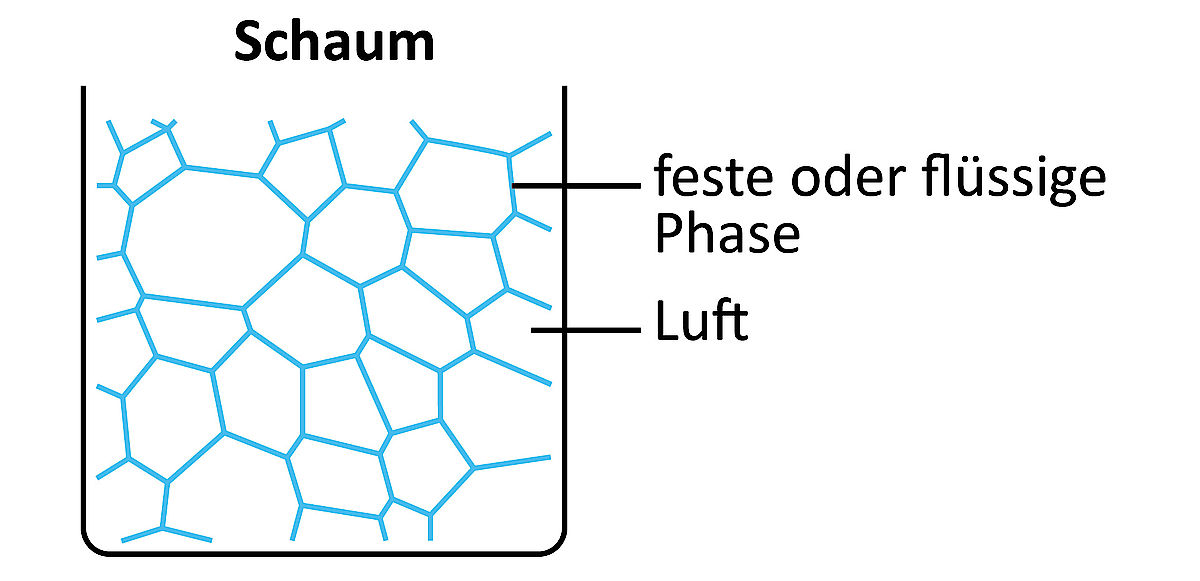
Schaum
Von Schaum spricht man, wenn Luftbläschen in einer flüssigen oder festen Phase verteilt sind. Es gibt verschiedene Arten von flüssigem Schaum: Beim Eischnee spricht man von proteinstabilisiertem Schaum, beim Schlagrahm von fettstabilisiertem Schaum. Ein Beispiel für einen festen Schaum ist Brot. In der Lebensmittelherstellung werden Produkte oft aufgeschäumt, um den Energiegehalt bei gleichbleibendem oder sogar verbessertem sensorischem Erlebnis zu senken.
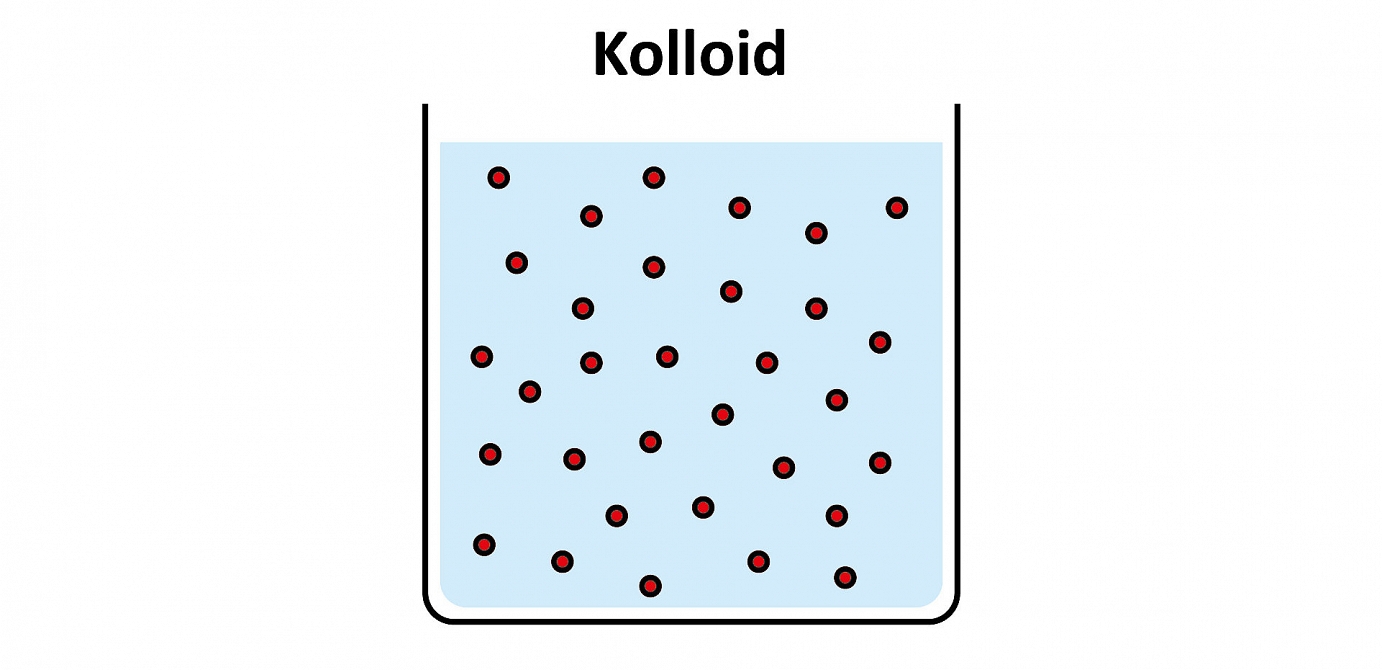
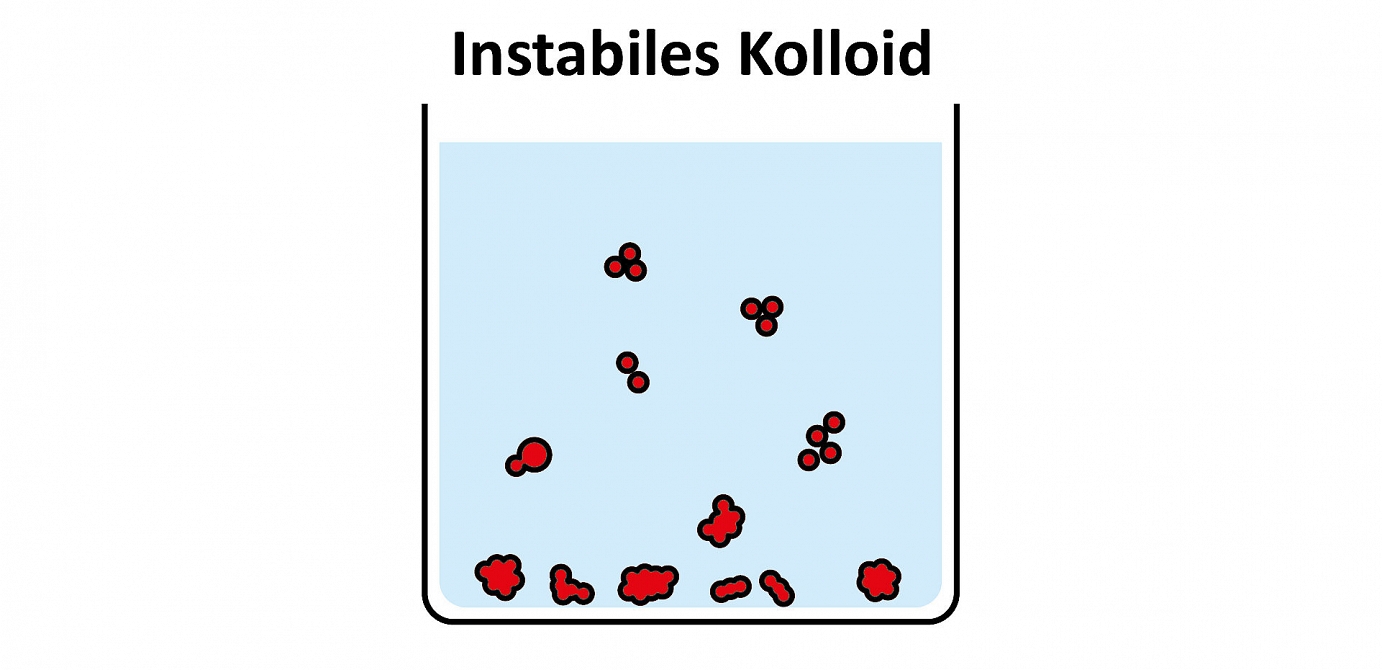
Kolloide
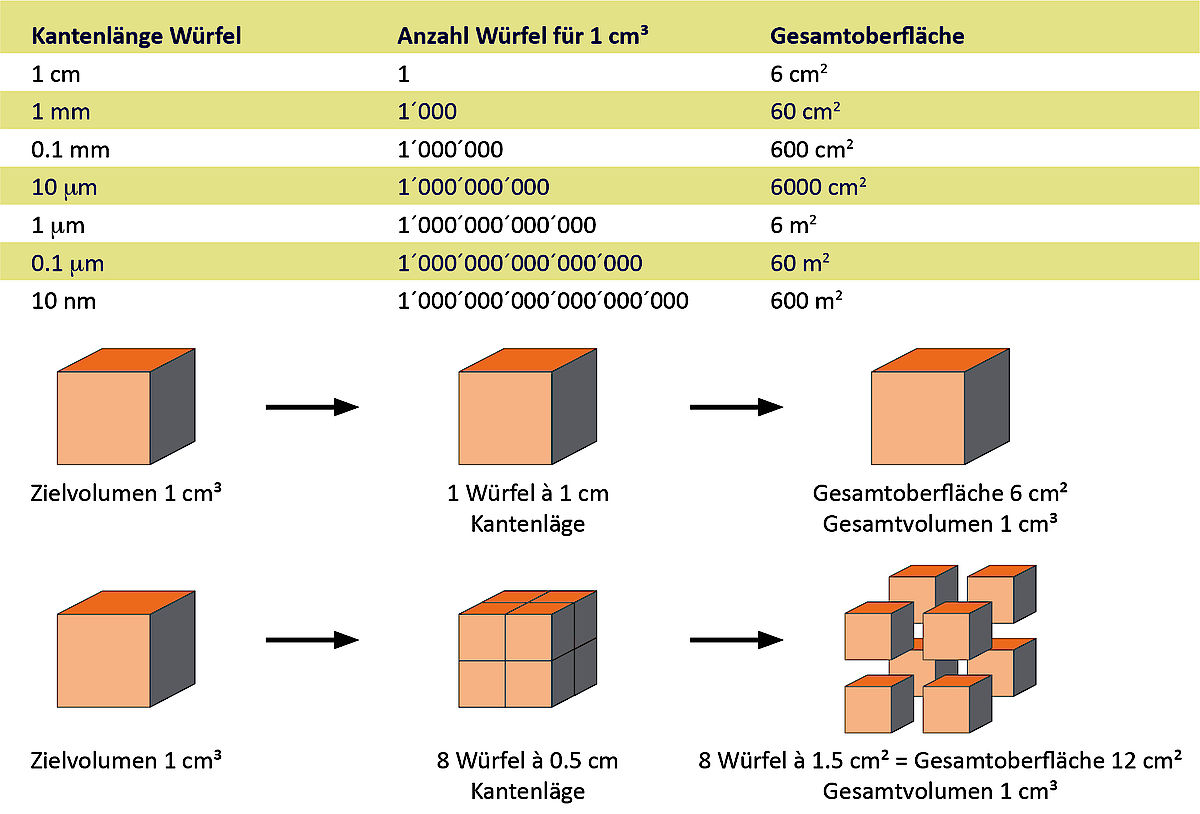
Kolloide sind kleine Teilchen, die in einem homogenen Medium (fest, flüssig oder gasförmig) fein verteilt sind. Milch (Fetttröpfchen in Wasser) ist z. B. ein kolloidales System. Die Gesamtoberfläche bzw. die Grenzfläche der fein verteilten Kolloide ist im Verhältnis zu ihrem Volumen sehr gross, wodurch sie leicht in Wechselwirkung treten. Bei einem instabilen Kolloid verschmelzen die kleinen Teilchen miteinander, man spricht dann von Koaleszenz. Dies kann z. B. zum Aufrahmen von Milch oder zur Sedimentation führen.
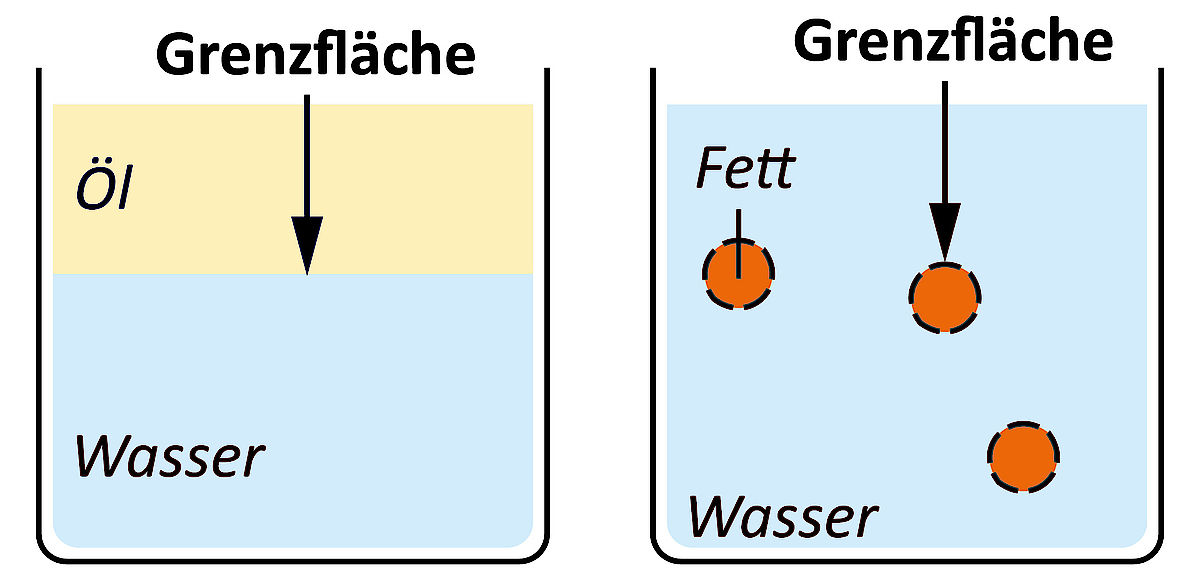
Grenzflächen
Als Grenzfläche bezeichnet man die Fläche zwischen zwei Phasen, z. B. zwischen einer flüssigen und einer festen Phase oder zwischen einer fetthaltigen und einer wässrigen Phase. Grenzflächen spielen beim Kochen und in der Lebensmittelherstellung eine grosse Rolle, da sie Geschmack oder Stabilität eines Produkts beeinflussen. So bewirkt eine Homogenisierung der Milch, bei der die Fettkügelchen zerkleinert werden, eine extreme Vergrösserung der Gesamtoberfläche. Dadurch wird die Milch leichter verdaulich und geschmackvoller, und ein Aufrahmen der Milch wird verhindert.